神経芽腫は、白血病や脳腫瘍に次いで多い小児がんで、1歳以下で発症することが最も多く、大部分は5歳以下で発見されます。神経芽腫のできやすい部位は、副腎といわれる腎臓の頭側にある臓器や、交感神経節と呼ばれる背骨の両側にある神経由来の組織です。交感神経節は首から骨盤まで続いているので、お腹の部分だけでなく、頚部、胸部、骨盤から発生することもあります。しかし、半数以上の方は腫瘍が転移を起こし、転移による症状で発見されます。たとえば、骨への転移による手足の痛みのために歩き方がおかしくなったり、目の奥の骨に転移すれば瞼が腫れたりします。発熱や顔色不良、不機嫌、元気がないなど漠然とした症状が続くこともあります。
お腹の腫瘍が大きくなれば、お腹全体の腫れとして気づかれ、お腹を触った時に硬いしこりを触れるようになります。健診で偶然に見つかる、あるいは胸のレントゲン写真を撮った時に偶然発見されることもあります。しかし腫瘍が進行して転移を起こし、転移部位の症状をきっかけに発見されることも多いです。たとえば、骨に転移すれば、頭のこぶ、目の腫れ、手足の痛みなどで発症します。痛みをうまく訴えられない子供の場合は、歩き方がおかしくなったり、歩かなくなったりすることで気づかれることもあります。骨髄にも転移を起こしやすく、その場合は顔色が悪くなったり(貧血)、青あざ(出血斑)ができやすくなったり、微熱が続いたりします。
神経芽腫は、カテコラミンという物質を作る腫瘍で、この物質を血液中へ放出します。この結果、血液中のノルエピネフリンというホルモンの検査値が正常より高くなり、神経芽腫の徴候とされています。また、血液中のカテコラミンは分解されて、バニリルマンデル酸(VMA)、ホモバニリン酸(HVA)となり尿中へ排泄されます。この結果、尿中のVMAとHVAが正常より高くなることが特徴です。したがって、尿中のVMAとHVAを測定することが診断に有用となります。その他に血液検査ではNSE、LDH、フェリチンなどが高値を示すことがあります。
画像検査には超音波検査、レントゲン検査、CT(コンピュータ断層撮影法)、MRI(磁気共鳴画像法)、核医学検査があります。 神経芽腫は腹部超音波検査や胸部レントゲン検査で偶然みつかることもあります。また、MRI、CTは腫瘍の発生場所や周囲の臓器や組織との関係を鮮明に映し出すことができ、転移部位の診断にも有用です。核医学検査にはMIBGシンチと骨シンチがあり、MIBGシンチは神経芽腫に特異的に取り込まれるため、診断、転移部位の判定、治療効果の評価に役立つ重要な検査です。骨シンチは骨転移の診断に有用です。
生検は腫瘍組織の一部を手術などで採取する手技のことで、大変重要な検査です。 採取した腫瘍組織は専門の病理医が顕微鏡により観察して確定診断(病理診断)を行います。さらに国際病理分類(INPC分類)という国際的に認められた共通の基準により、予後良好群と予後不良群に分類し、リスクの判定に用います。
神経芽腫は骨髄に転移をしやすい腫瘍であり、微小な骨髄転移は画像検査では見つけることができないため、骨髄を直接採取して調べることが必要です。
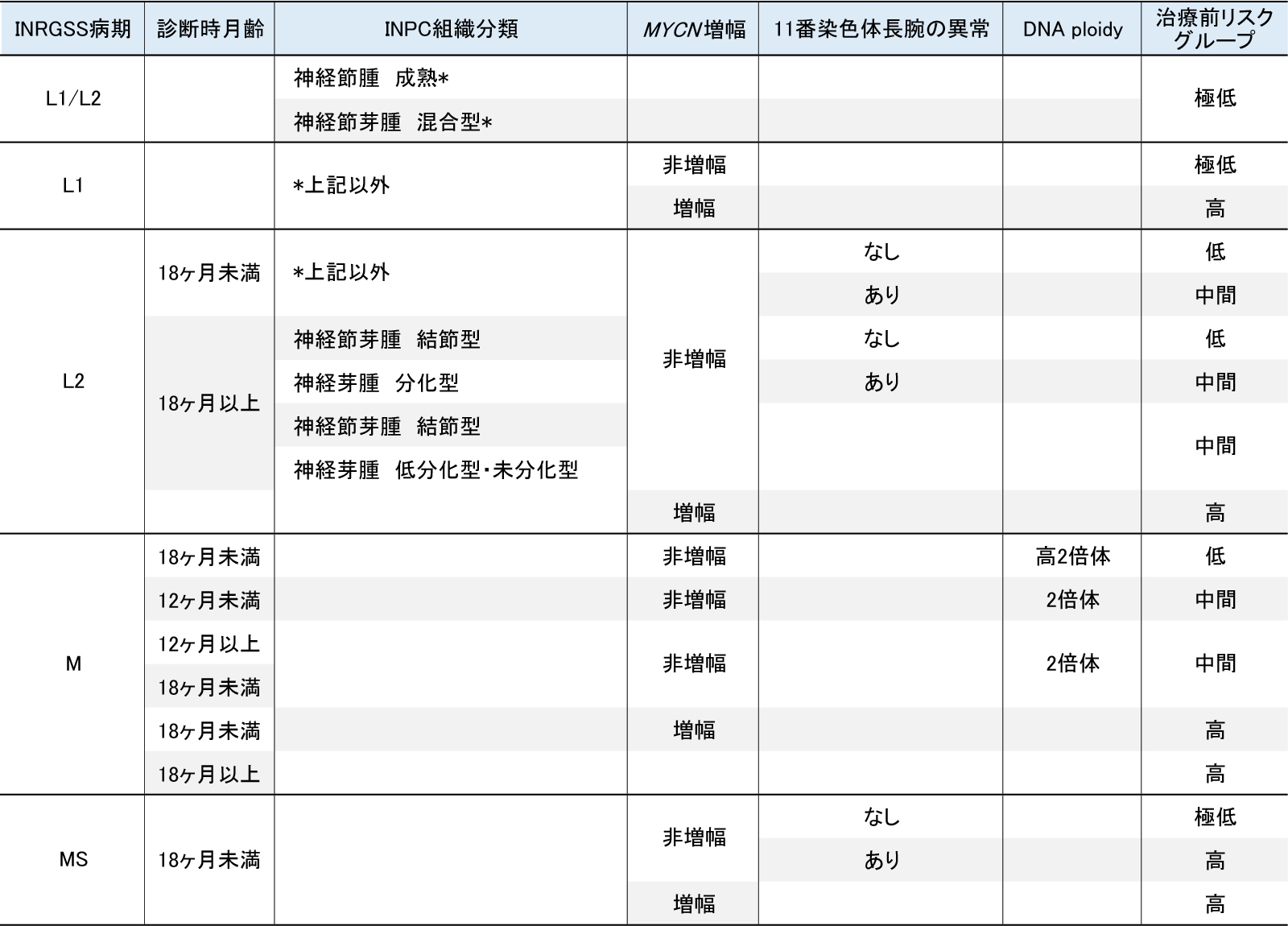
一般に神経芽腫は、臨床病期、年齢、腫瘍細胞内のMYCN遺伝子のコピー数、国際病理分類、腫瘍細胞内の染色体の数(プロイディ)の5つの予後因子を用いて、4つのリスク群(極低リスク、低リスク、中間リスク、高リスク)に分類し、リスクに応じて治療法を選択します。
極低リスクの腫瘍を持つ患者さんは無治療で退縮や分化する場合があります。また、手術のみで治療できます。低リスクは最も治りやすいグループで、約9割の患者さんが手術のみで治ると考えられています。残りの1割の患者さんは比較的弱い化学療法が必要ですが、全体でも90から100%の患者さんが長期生存します。
中間リスクは手術と低リスクより強い化学療法が必要です。これにより全体で70から90%の患者さんが長期生存します。治療に伴う合併症も見過ごせないことから、合併症を少なくし、治療成績をもっと向上させることが課題となります。
高リスクは最も治りにくいグループで、治療法の中心は化学療法です。最も強い化学療法と造血幹細胞移植を併用した超大量抗がん剤療法、放射線療法、抗体療法が行われることが一般的です。手術は補助的な役割となります。このような強力な治療にもかかわらず、全体の長期生存は約50%であり、生存率を改善することが最大の課題です。
本邦では、現在、神経芽腫委員会が中心となって、神経芽腫に対する標準治療と新たな治療法の確立のために、臨床試験を行っています。そのなかでは、上記のリスク分類に応じて、化学療法、外科療法、放射線療法を組み合わせて治療を行います。低リスク群では手術のみで治療が行われる場合も多く、生検のみや残存腫瘍がある場合は、最も治療強度の弱い化学療法が選択されます。また、中間リスク群では手術と化学療法が併用され、化学療法は低リスクよりも強くなり、転移がある場合にはその部分に放射線治療が追加されます。高リスク群では、造血幹細胞移植を用いた大量化学療法に外科療法と放射線療法が併用され、治療期間も長期化することになります。
化学療法は、主にビンクリスチン(VCR)、シクロホスファミド(CPA)、イホスファミド(IFO)、ドキソルビシン(DXR)、ピラルビシン(THP)、シスプラチン(CDDP)、カルボプラチン(CBDCA)、エトポシド(VP-16)などを中心に、これらを組み合わせた多剤併用療法が行われます。
手術療法としては、最近、抗がん剤による治療の進歩により手術に対する考え方は大きく変わってきており、低中間リスクにおいては、CTやMRIなどを使った画像診断で、手術の困難性を客観的に判断する国際的な基準(IDRF)が決定され、IDRF陰性の場合には手術を先に行い、IDRF陽性の場合には初めに生検を行い、抗がん剤による術前治療を行い、IDRFがなくなれば、その時点で手術を検討します。術前治療をしてもIDRFがなくならない場合も少なくなく、その場合には、規定の治療が終了した時点で手術を検討します。高リスクに対しては、最初に生検を行い、化学療法後に根治手術を行います。しかし、切除困難な場合も多く、必ずしも切除が根治に必要でない場合もあり、慎重に適応を決定します。いずれにせよ、腎臓を含めた周囲臓器を温存することが最優先となります。
それぞれの抗がん剤には共通する副作用と各々に特有な副作用があります。この副作用は使用する抗がん剤の量、投与方法、投与間隔、組み合わせにより異なってきますので、化学療法を受ける場合には、十分な説明を受け、化学療法の経験のある専門医がいる施設で治療を受けることをお勧めします。
現在の、神経芽腫委員会で登録中あるいは解析中の臨床試験の考え方としては、
① 低リスク群:このグループの治療成績は極めて良好なため、手術および化学療法に伴う合併症を減らす目的の試験が行われています。そこでは初回全摘による化学療法の省略や治療期間の短縮が目的となっており(JN-L-10)、さらに現在は診断時血清MYCN遺伝子増幅の有無により無治療経過観察することも行っています(JN-L-16)。
② 中間リスク群:手術および化学療法に伴う合併症を減らすため、低用量の術前化学療法、大量化学療法を併用しない治療計画、IDRFに基づく手術時期の決定により、治療合併症の軽減と治療期間の短縮を図ることを目指しています(JN-I-10)。
③ 高リスク群:このグループの治療成績はいまだ不良のため、化学療法の強化と手術時期を大量化学療法後にもってくることで治療遅延を防ぐことを目的とした試験が行われました(JN-H-11、JN-H-15)。また、現在は、特に予後が悪いと考えられる群については、化学療法の追加と KIR リガンド不一致同種臍帯血移植を行う臨床試験が行われています(JN-H-20)。